「digzyme Custom Enzyme Lab」で期待される実用化例:糖鎖構造構築および難分解性物質へのアプローチ
はじめに
2025年5⽉21⽇(水)、22(木)、23 ⽇(金)
と3日間に渡り開催されたifia JAPAN 2025。
昨年と同様、弊社の代表取締役、渡来が出展者プレゼンテーションを行いました。
その様子をYOUTUBEで公開いたしましたので、ぜひご覧ください。
今回の出展者プレゼンテーションでは、2025年5月21日にローンチされた「digzyme Custom Enzyme Lab」についてご紹介しました。当日は、DRY技術(バイオインフォマティクス解析)とWET技術(実験検証)という二つの技術的アプローチに触れつつ、プラットフォーム全体の概要をお伝えしました。
本記事では、その中で取り上げた『「digzyme Custom Enzyme Lab」で期待される実用化例』2件について、渡来の視点を通じて、各事例における技術的ブレイクスルーやin silico設計の裏側をQ&A方式で詳しくご紹介します。
当日のプレゼンテーションでは全体像のご紹介にとどまりましたが、本記事を通じて、「digzyme Custom Enzyme Lab」の実力と可能性をより具体的にご理解いただける内容となっております。ぜひ最後までご覧ください。
まずは一つ目の事例についてです。

「digzyme Custom Enzyme Lab」で期待される実用化例1
Q.この成果の最も大きな意義は何だと考えていますか?
A.糖質は、構成する糖の結合様式の違いによって物性の差が生まれます。in silico技術で、目的の糖鎖構造を作る酵素を狙って探索ができた例は学術的にも稀で、かつ10個という少数の実験で発見できたことは非常に価値が高いと考えています。
Q.これまでのアプローチと比べて、今回のアプローチは何が革新的だったのでしょうか?
A.本件は、結果的には、当時のAlphaFold2に代表される深層学習(DL)ベースの構造予測技術に対して、弊社独自の詳細な分析技術を適用した点が役に立ちました。これまでのhomologyベースのモデルでは、糖鎖構造を作り分ける微妙なタンパク質構造の違いまでは予測することが困難でしたが、当時のAI技術によりそれらの特徴を一定程度捉えられたと考えています。
(なお、現在の生成モデルを用いた最新のAI技術とはギャップがあるため、本稿では便宜的に「AI」とまとめて表現しております。)
Q.チームや関係者のどのような努力がこの成果につながったと思いますか?
A.担当の研究員が、顧客ニーズを詳しく深堀りして当該酵素のスクリーニング基準をうまく設定し、基盤開発メンバーと連携することで解析プログラムを個別に作成し、この成果につながりました。当社では、既存プラットフォームだけで達成できない課題に対しても、フレキシブルにツール開発を行える点が強みだと思っています。
次に、三菱ケミカル株式会社と共同で行った、二つ目の事例についてです。
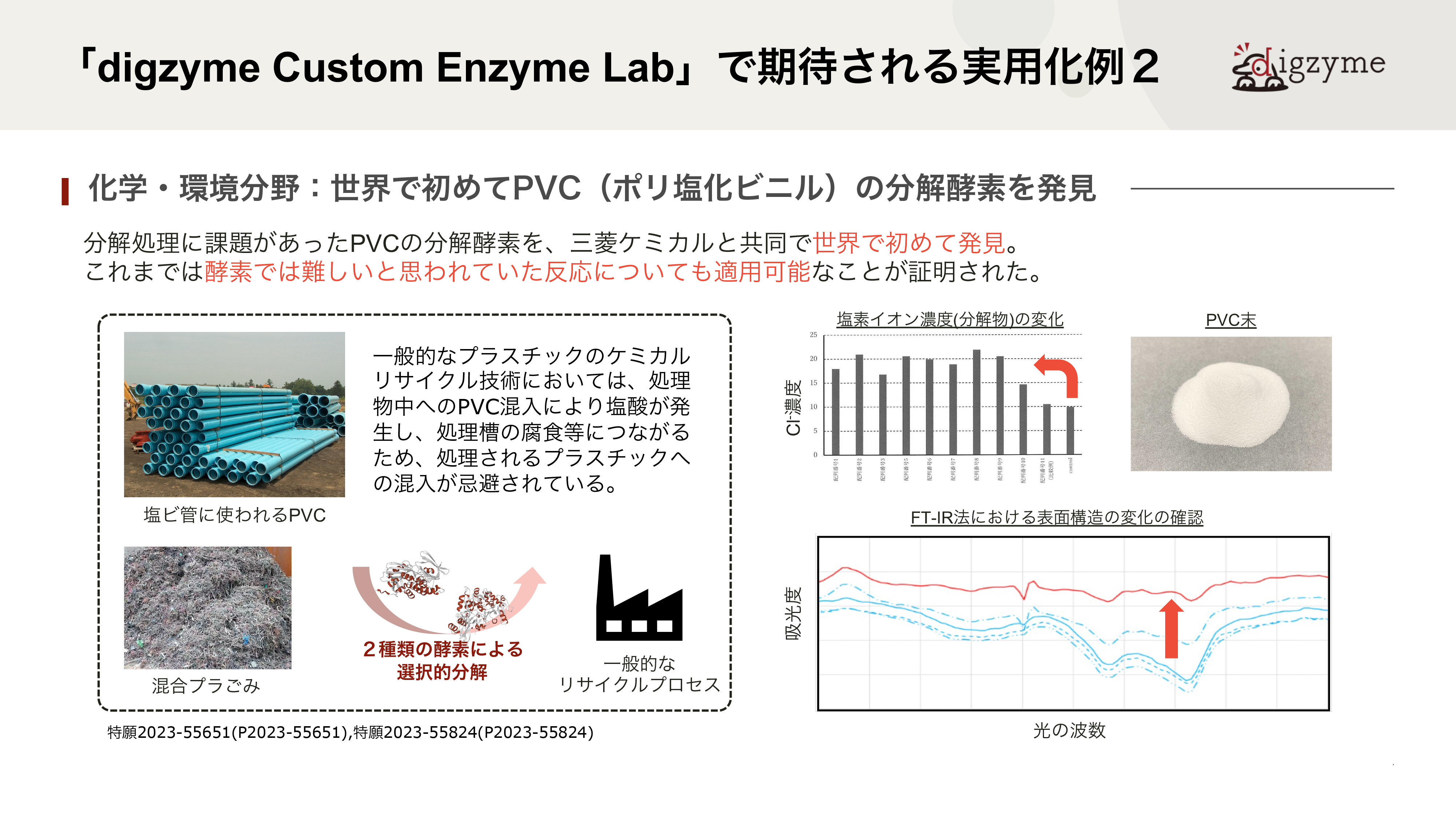
「digzyme Custom Enzyme Lab」で期待される実用化例2
Q.この成果の最も大きな意義は何だと考えていますか?
A.PVCは20世紀から本格的な生産が始まった自然界にない物質で、天然の微生物が進化の過程で分解機構を獲得していないと仮定すると、最適化された酵素は天然からは見つからないはずです。一方で、生物は休眠遺伝子を含めて”最適化されていない”さまざまな遺伝子をゲノムに保有しており、結果として環境変化への適応に活かされるとされています。本件は、その環境適応に寄与しうる酵素をin silicoで人工的に見つける問題とも捉えられるため、難易度が高いテーマでした。
Q.従来、このような酵素を発見するにはどれほどの時間やコストが必要でしたか?
A.近年、人工的なプラスチックの分解酵素を、集積培養に近い形で見出す研究がいくつか見られます。例えば、ある樹脂を海底に一定期間沈めておき、引き上げた後に分解の様子を観察したり、バイオフィルムに含まれる微生物を単離培養したりします。うまくいく場合には、分解酵素を持つ微生物が見つかるので、ゲノム解析やBACライブラリ作成などを通じて分解酵素を同定することが出来ますが、分解が遅いという性質上、どうしても年単位での時間がかかってしまいます。もちろん、分解が観察されず、うまくいかないケースも数多くあると思っています。in silicoでの探索は長くても半年程度で済むため、このような実験時間が長くかかってしまう対象に対してもある程度効果的に用いることが可能です。
終わりに
渡来は、今回の出展者プレゼンテーションを振り返りながら、次のように語っています。
「『digzyme Custom Enzyme Lab』でも、事前の準備期間の中で、これらの共同研究ケースのようなin silicoライブラリを作成して進めていくことができます。高精度のライブラリから精製酵素を試したいお客様におすすめしたいサービスです。」
このコメントが示すように、バイオインフォマティクスを基盤とした酵素設計アプローチは、限られたリソースの中でも実用的な酵素開発を加速しうる可能性を持っています。
今後さらに、酵素の多様な分野への応用が進む中で、「digzyme Custom Enzyme Lab」はその中核を担う技術基盤として重要な役割を果たすと考えられます。
ifia JAPAN 2025会場で頂戴したご質問への回答まとめ
はじめに
食品事業部の村瀬です。
弊社は、2025年5月21日(水)〜23日(金)に東京ビッグサイトで開催された「ifia JAPAN 2025 第30回 国際食品素材/添加物展・会議」(主催:食品化学新聞社)に、昨年に続いて出展いたしました。
会期中は、弊社の技術に高い関心をお持ちの多くの来場者の方々と、直接お話しできる貴重な機会となりました。
出展ブースでは、そうした皆さまに向けて、弊社の最新の取り組みをご紹介していましたが、なかでも大きな目玉となっていたのが、新しいソリューション「digzyme Custom Enzyme Lab」のローンチについてです。(詳しくはプレスリリースをご覧ください:https://prtimes.jp/main/html/rd/p/000000018.000050097.html)


ローンチにあたり、想定を上回る多くのご反響をいただき、出展ブースでは連日、多くの方から具体的なご質問やご相談をいただき、終始活発な対話の場となりました。
そこで今回のテックブログでは、「digzyme Custom Enzyme Lab」のローンチを記念した特別編として、会期中にいただいたご質問の中から、特に多かった内容をピックアップし、回答と合わせてQ&A形式でご紹介します。
本ソリューションにご興味をお持ちの方はもちろん、「酵素を使った開発に関心はあるけれど、何から始めたらよいのかわからない」という方にも、ヒントとなる内容です。ぜひ最後までご覧ください。
Q:「digzyme Custom Enzyme Lab」は、どんな開発テーマに利用できる?
A:「digzyme Custom Enzyme Lab」は、「現行の酵素を用いた製造法の効率向上」のような具体的な開発テーマから、「(酵素を用いた)新規食品素材開発」のような抽象度の高い開発テーマにもご利用いただけるソリューションとなっております。精製酵素サンプル提供とお客様での酵素評価のフィードバックを繰り返し行うことで、随時開発方針の調整が可能です。
Q:提供される精製酵素サンプルについて、どんな情報が提供される?
A:基本的な酵素活性の有無、プロファイル(至適温度、至適pH、熱安定性、pH安定性)の確認を弊社で行い、サンプル提供と併せて提出いたします。実際の評価系での実証実験については、お客様ご自身で確認することができます。
Q:提供される精製酵素のサンプル量はどれくらい?
A:開発テーマごとにもご相談となりますが、典型的には、酵素溶液として~mL、タンパク質として~mg単位でのご提供となります。
Q:初期開発期間はどのように決まる?
A:お客様がご希望するテーマについて、事前に弊社で開発方法の検討・調査を行い、初期開発期間を決定いたします。基本的には、2〜6ヶ月の間で初期開発(in silico酵素デザイン〜初回提供精製酵素サンプル製造)を行います。
Q:遺伝子組み換え技術を利用しない方法での酵素開発も可能?
A:可能です。詳細は、「digzyme Express」のご紹介ページ(https://www.digzyme.com/cms/wp-content/uploads/digzyme_Express_ol.pdf)をご参照ください。
Q:「digzyme Custom Enzyme Lab」は食品産業向けのみのソリューション?
A:「digzyme Custom Enzyme Lab」は、食品産業だけでなく、化学産業など業種を問わずご利用いただけるソリューションです。
Q:提供された精製酵素サンプルの中から、希望に合う酵素が見つかった場合、その後はどうなる?
A:「digzyme Custom Enzyme Lab」で開発された酵素については、シームレスに製造に向けた開発へ進めていくことが可能です。digzymeでは、該当酵素の製造技術開発・各種認可まで、お客様の開発テーマの事業化に最後まで伴走いたします。
Q:開発した酵素ライブラリの知財の扱いはどのようになっている?
A:digzyme Custom Enzyme Labで開発した酵素の中から有望な酵素を見出すことができ、更にそれを利用した事業化をご検討される際には、ご要望に応じて柔軟に対応させていただきます。
以上、「digzyme Custom Enzyme Lab」でご提供致しております内容についてご回答申し上げましたが、実際の開発の際には、お客様のご要望に応じて柔軟に対応させていただきますので、お気軽にご相談ください。
今回のQ&Aは以上となります。
最後までお読みいただき、ありがとうございました。
ご不明な点やご質問がありましたら、ぜひ下記のコンタクトフォームよりお気軽にお問い合わせください。
【▼コンタクトフォーム】
https://www.digzyme.com/contact/
糖鎖データベースからの目的単糖を含む多糖の検索と可視化
はじめに
digzymeにてインターン勤務させていただいております、東京大学修士2年の高栁龍です。大学では、タンパク質のリン酸化やタンパク質立体構造に関連した研究などを行っています。今回のtechblogでは、研究開発業務の一環として新たに開発しました、目的単糖を含む多糖の網羅的検索と可視化ツールであるGlycoSearcherを紹介いたします。
近年、デンプンや食物繊維で代表されるように、糖鎖など多糖の研究と産業利用が活発となってきています。新規の糖質を開発する需要が上がってきており、その中で多糖は構造の多様性が非常に高いものとして注目されています。そこで、様々な多糖を網羅的に検索するためのツールとして、新たにGlycoSearcherを開発いたしました。
多糖の記述方式とデータベース
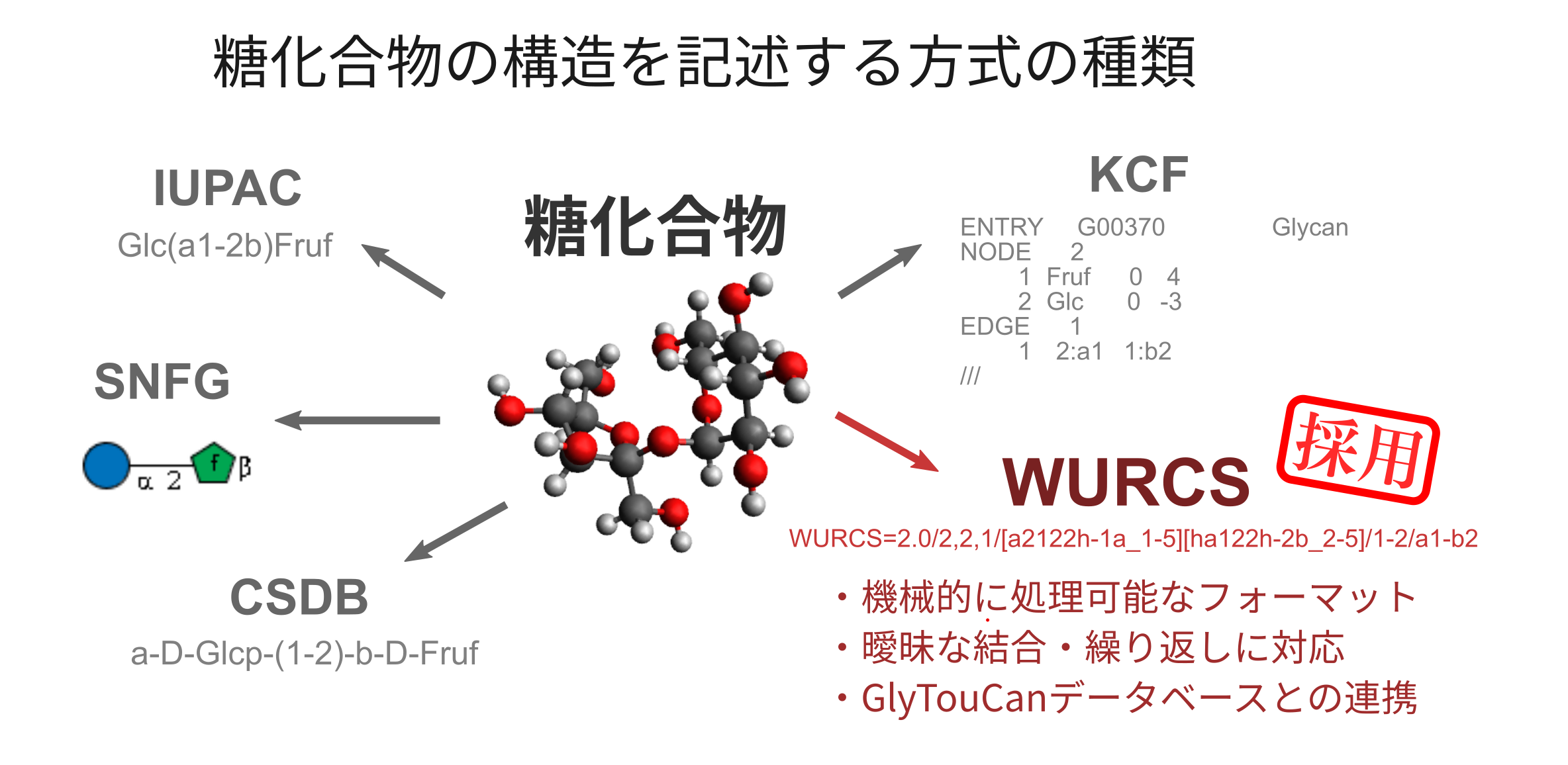
今回対象としている糖化合物は、既に数十万を超える数が報告されており、データベース化されています。こうした多くの糖化合物の中から目的に沿った多糖を厳選し、合成経路の探索や酵素開発などの応用につなげるには、計算処理しやすい記述方式と網羅性の高いデータベースが必要となります。
糖化合物の構造を記述する方式には様々なものが知られています(図1)。SNFGやKCFといった形式は可視化にすぐれていますが、構造情報の抽出や比較など応用的な計算処理には不向きです。一方、IUPACは、人と機械の両方が読み取り可能で簡潔な構造表現ですが、繰り返しなど複雑で曖昧な表現に対応するのは難しいです[1]。そこで、GlycoSearcherでは、計算処理に適し、繰り返し表現可能なWURCS形式、およびWURCS形式での糖化合物情報を収集したGlyTouCanデータベース[2]を採用しました。
(図1)
GlycoSearcherを用いた検索
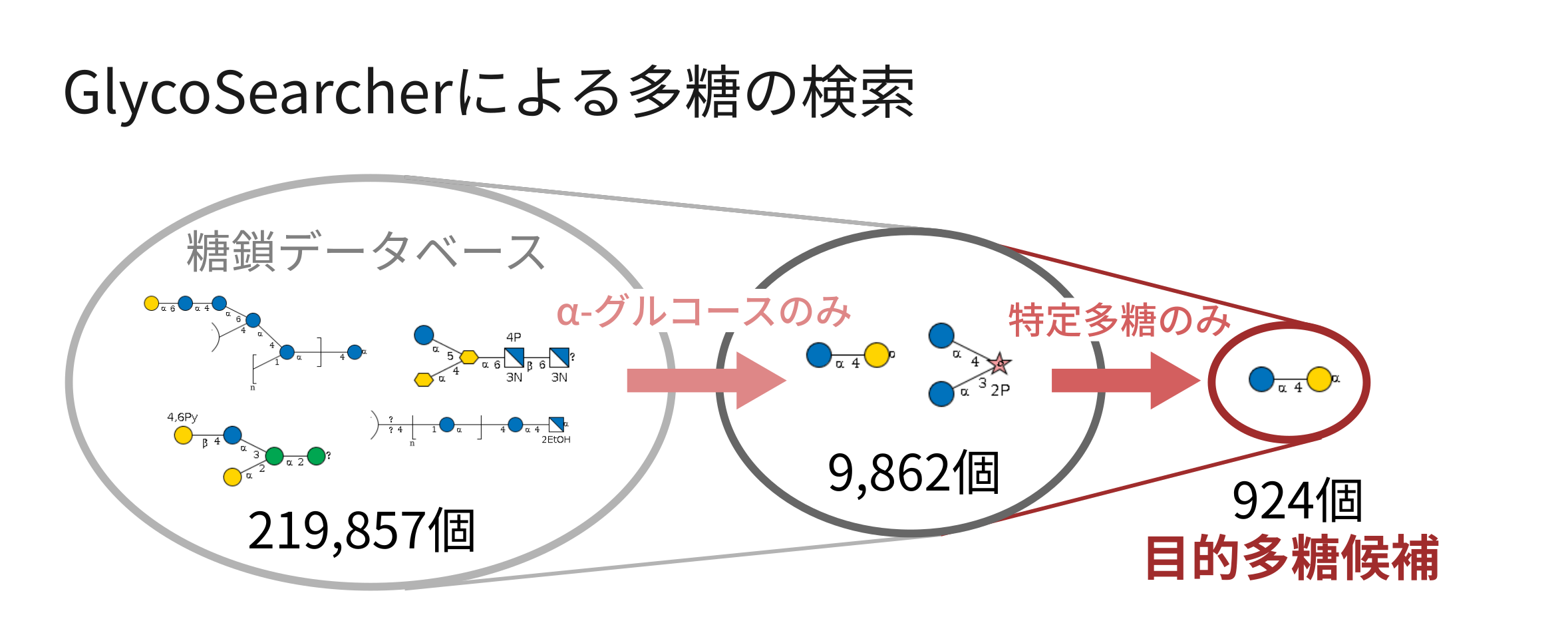
ここにGlycoSearcherでは、膨大な量の候補から目的に沿った多糖を抽出することが可能です。例えば、グルコースやガラクトースなど、特定の単糖単位を含む多糖を検索することができます。さらに、多糖を構成する単糖単位を一部のものに限定する、フィルタリング機能も兼ね備えています。これにより、ある特定の単糖を原料とし、その他特定の糖のみを用いて合成可能な多糖を列挙することができます。
以下に、α-グルコースを例に実行した結果を紹介します(図2)。219,857個ある糖鎖の中から、α-グルコースを含む多糖を検索したところ、9,862個が検出されました。さらに、構成単糖をグルコース・ガラクトース・フルクトースのみに絞ったところ、924個まで候補が減少しました。
(図2)
多糖構造の可視化と特徴抽出
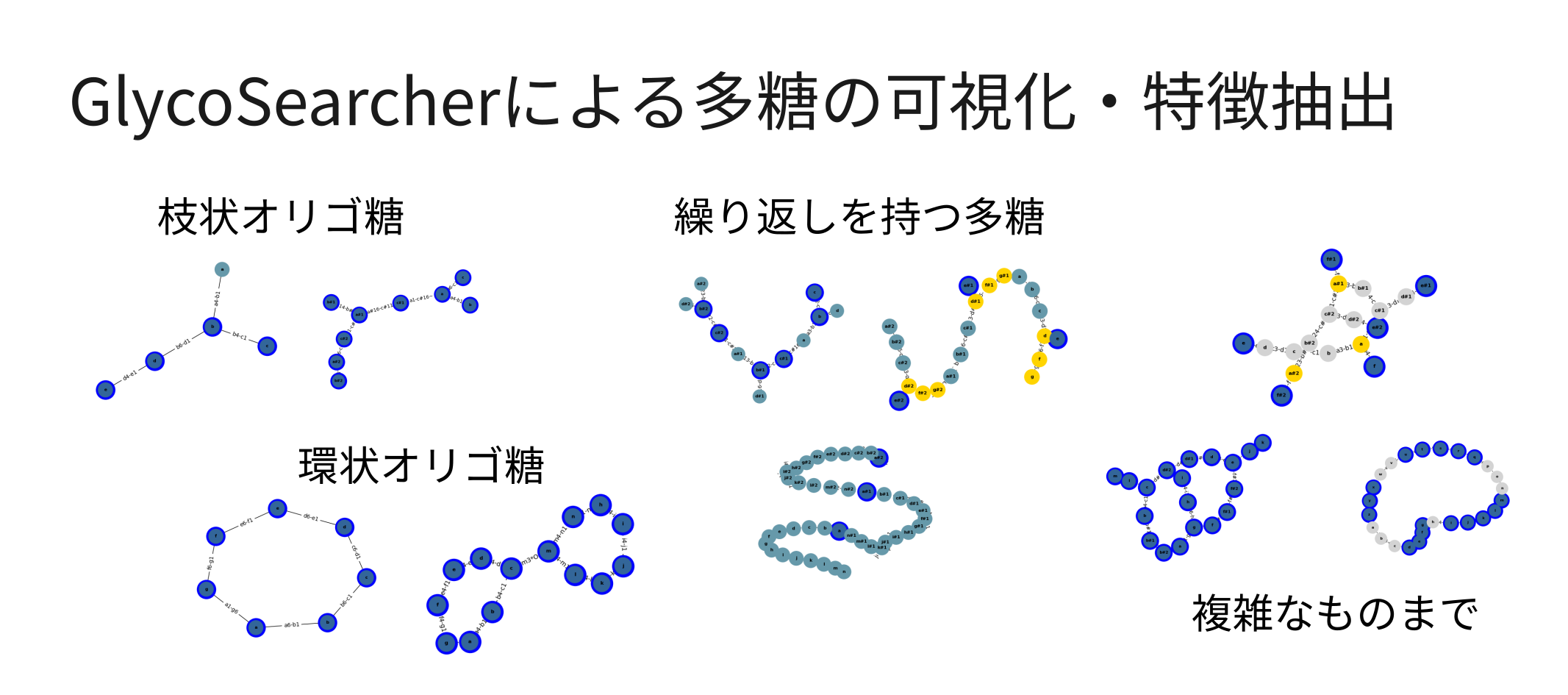
得られた検索結果は、効果的に可視化され、続く応用処理へと活かすことができます(図3)。WURCS形式の多糖をグラフとして再構成することで、数千個の検索結果を数分のうちに描きだすなど、高速な可視化が可能です。また、曖昧な繰り返し回数を持つ構造についても、特定の回数だけ繰り返しを展開することで、実質的な構造を可視化するのみならず、曖昧なままでは難しい構造間の比較など、更なる計算処理へとスムーズに移行させることができます。
検索結果の多糖がグラフ化されていることから、多糖構造に対する特徴抽出も可能です。例えば、得られた多糖構造の末端にグルコース単位が存在しているか、あるいは特定の構造(モチーフ)を含むか、といった計算を行うことができます。さらに、検索によってヒットした多糖について、PubChem[3]などの各種データベースと統合させることで、その一般名や関連する酵素情報と統合させることができ、多糖を含む反応についての情報を得ることが可能です。
(図3)
終わりに
今回開発したGlycoSearcherでは、目的の多糖をデータベースから網羅的に検索し、更なる計算処理へと応用させることができました。さらに、得られた目的多糖候補から情報を抽出しその合成に関与すると予測される酵素情報を取得することで、その後の酵素デザインのワークフローにつなげる体制を整えられました。
謝辞
糖化合物に関する知識の習得を始めとしたGlycoSearcherの開発には、事業開発部の礒崎さんに大変お世話になりました。この場を借りて感謝申し上げます。
参考文献
[1] 細田 正恵, 木下 聖子.「糖鎖関連インフォマティクスへの入り口」 JSBi Bioinformatics Review, 2(1), 87-95 (2021).
[2] https://glytoucan.org/
[3] https://pubchem.ncbi.nlm.nih.gov/
人工的な合成経路探索
はじめに
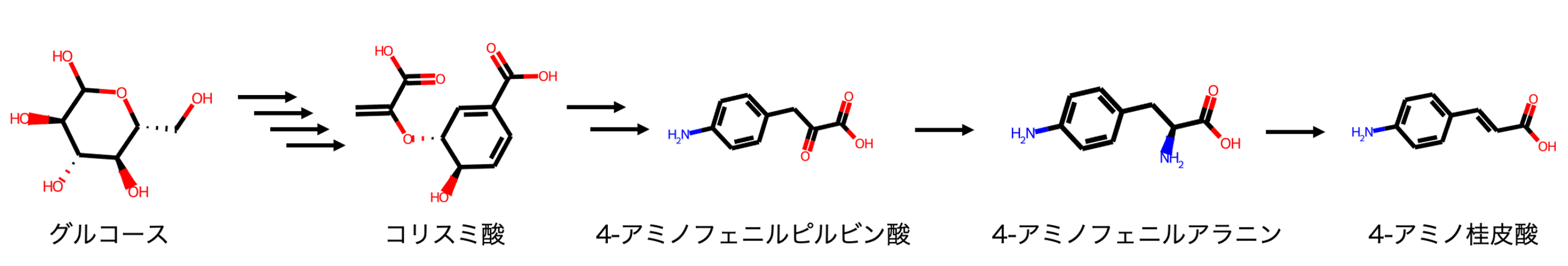
事業開発部の礒崎です。弊社では酵素反応による原料から目的物までの人工的な合成ルート探索を行っています。目的物と原料の化合物構造データを入力するだけで、原料から目的物を合成する可能性のあるルート候補を出力します。本ブログでは、その具体例として高強度ポリマーの原材料となる化合物4-アミノ桂皮酸をグルコースから合成するルートを予測し、反応を担う酵素を予測した結果をご紹介します。
合成経路探索に使用した材料
Tateyama et al., 2016において、高強度のポリマーを生産するための原材料として4-アミノ桂皮酸を使用しています。この4-アミノ桂皮酸を合成するために使用された経路が図1です。グルコースを原料としてStreptomyces venezuelae 由来のAminodeoxychorismate synthase (PapA)とS. pristinaespiralis由来の Aminodeoxychorismate synthase (PapBC)を導入した大腸菌により4-アミノフェニルアラニンを生産させます。さらに、この4-アミノフェニルアラニンを原料としてRhodotorula glutinisのPhenylalanine ammonia-lyase (RgPAL)を導入した大腸菌に加えて、4-アミノ桂皮酸を生産させます。
結果
1. 生合成経路探索
原料をグルコース、生成物を4-アミノ桂皮酸として入力することで図1のような人工合成経路が出力されました。グルコースからコリスミ酸の既知合成経路と同一の経路が出力され、4−アミノフェニルアラニンを介して4-アミノ桂皮酸を合成する経路が出力されました。
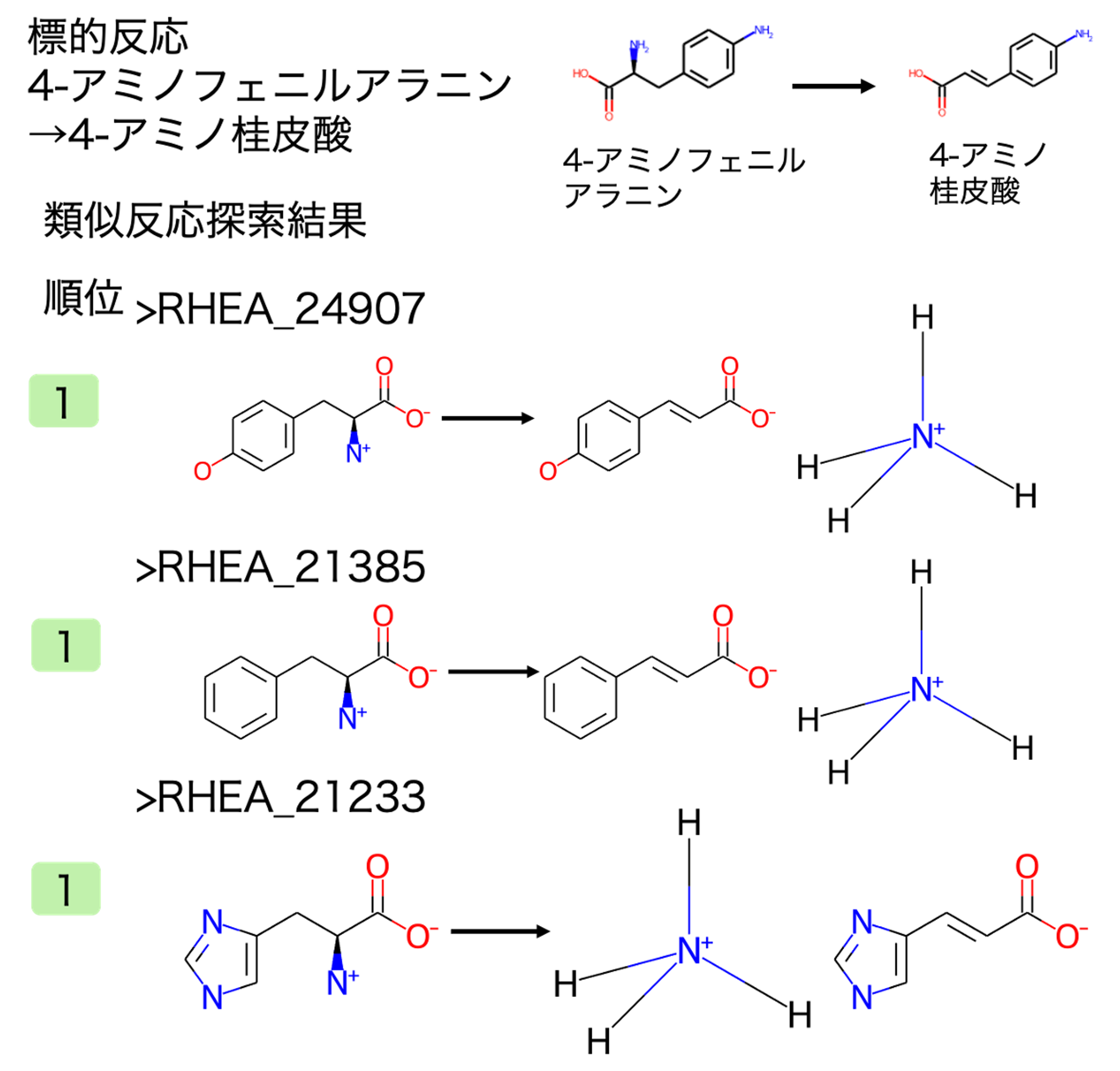
2. 類似反応探索
結果1で見出した人工的な合成経路のうち、4-アミノフェニルアラニン→4-アミノ桂皮酸の類似反応を探索しました。
類似反応探索により、アミノ基を脱離し、二重結合を生成する反応が抽出されました。標的反応との反応類似度が高い類似反応の一部とその順位を図2に示しました。標的反応と完全に一致する反応を含む類似反応が抽出されました。
3. 類似反応該当酵素探索
結果2で標的反応の類似反応を抽出しました。この類似反応を担う酵素配列をtaxonごとに抽出しました。絞り込んだ配列と論文中で使用された酵素を比較しました。Rhodotorula属、Eukaryotaドメイン、全taxonの3段階で配列を抽出しました(表1)。抽出した配列には、論文で使用された配列と90%以上の配列相同性を示すものが含まれていました。

終わりに
本ブログでは人工的な合成経路の探索を実演しました。材料として高強度ポリマーの原材料となる化合物4-アミノ桂皮酸をグルコース から合成する人工的な経路を探索しました。この経路のうち、4-アミノフェニルアラニンから4-アミノ桂皮酸を合成する酵素を類似反応酵素探索技術を用いて見つけることができるか試しました。上記の反応に対して、任意のtaxonごとに配列を抽出し、それぞれの配列数を示しました。実際に論文で使っていた酵素に非常に近い配列を含む複数の配列を抽出することができました。
謝辞
今回の合成経路探索には以下の論文のデータを利用させていただきました。
Tateyama et al., (2016) Ultrastrong, Transparent Polytruxillamides Derived from Microbial Photodimers. Maclomolecules.
未知反応を触媒する酵素探索
はじめに
事業開発部の礒崎です。弊社では未知反応を担う酵素探索を行っています。既知酵素反応との反応類似度および既知反応を担う酵素配列との配列相同性を基にして、標的の未知反応を担う酵素配列候補を出力します。本ブログでは、その具体例としてエイズ治療薬候補の1つIslatravirという化合物の合成反応を実際に担う酵素配列を予測した結果をご紹介します。
酵素探索に使用した材料
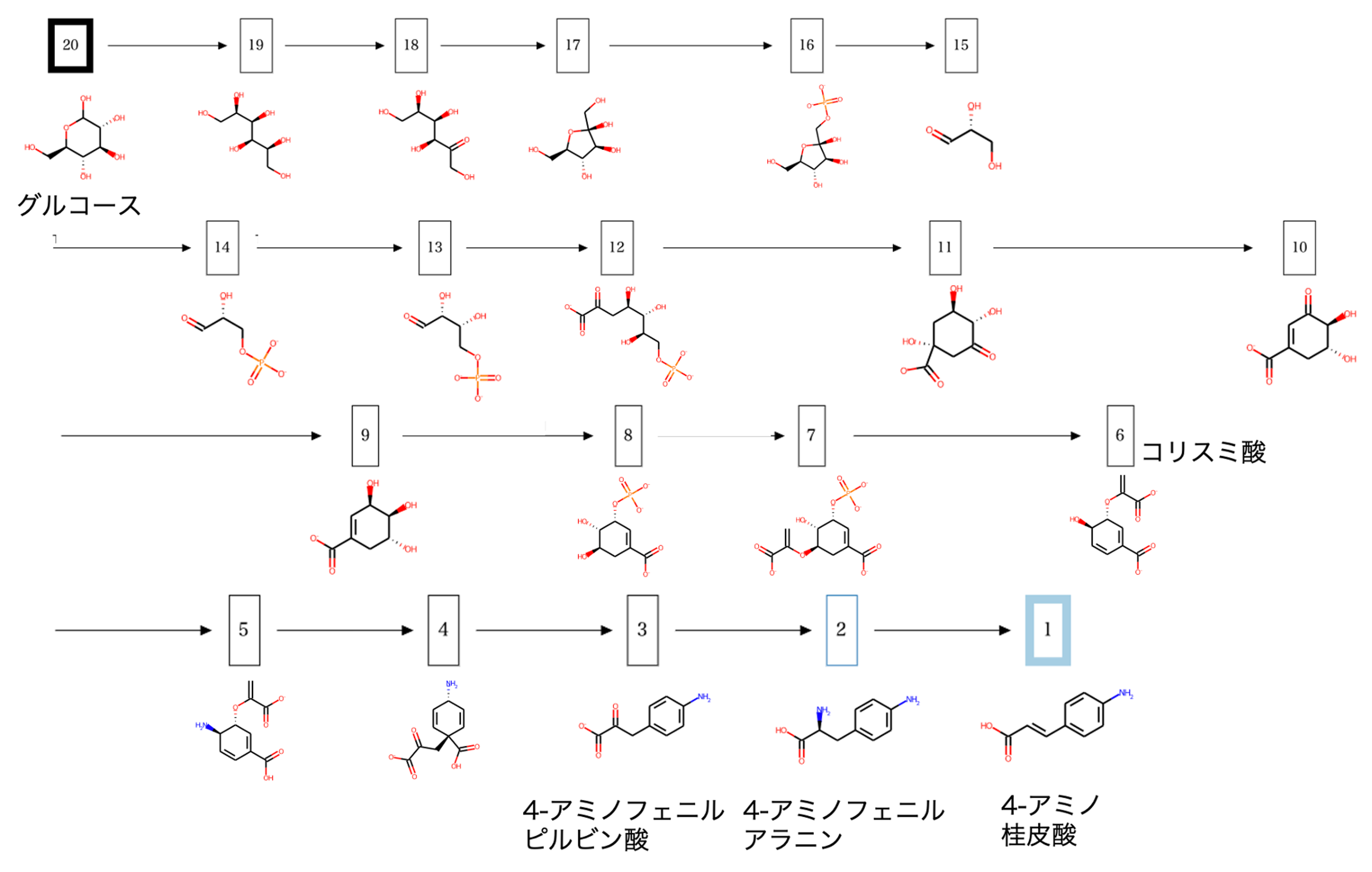
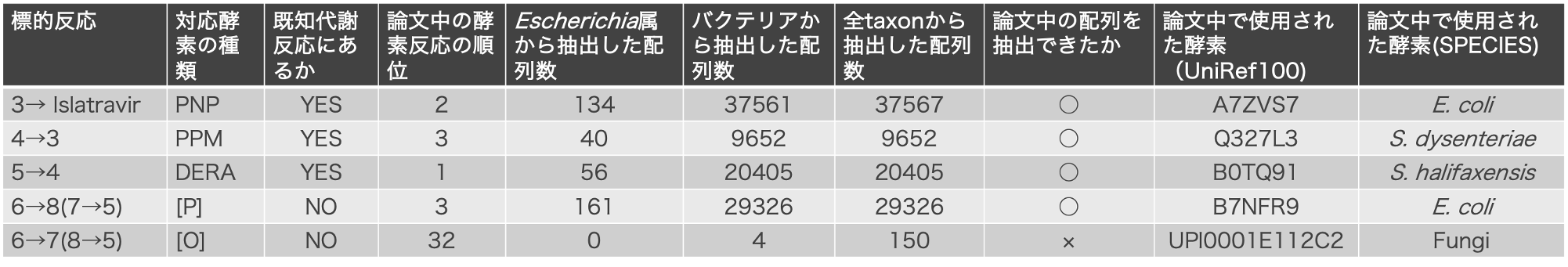
Huffman et al., 2019のデータを使わせていただきました。この論文ではIslatravirの新規合成経路を設計し、経路中の反応それぞれを触媒する酵素を見つけ、その実証実験を行っていました。Islatravirの合成反応を図1に示しました。化合物6 → 化合物7 or 8 → 化合物5 → 化合物4 → 化合物3 + 化合物2 → Islatravirという順番に合成されます。この合成経路の各反応を担う酵素を弊社の酵素探索技術で予測し、論文で使用された酵素と比較しました。

結果
まずは、合成経路の5反応それぞれと類似する反応を探索しました。
1. 類似反応探索
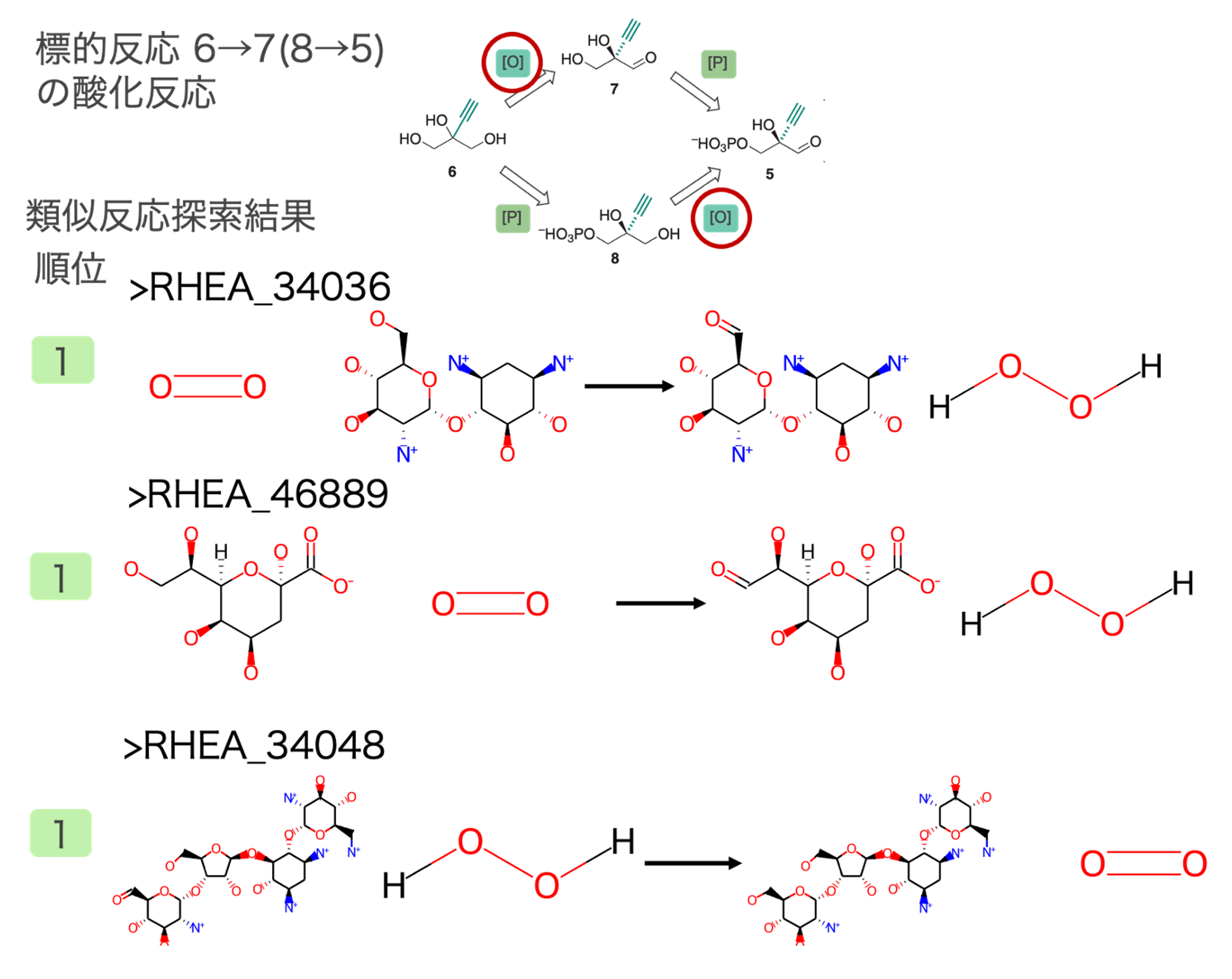
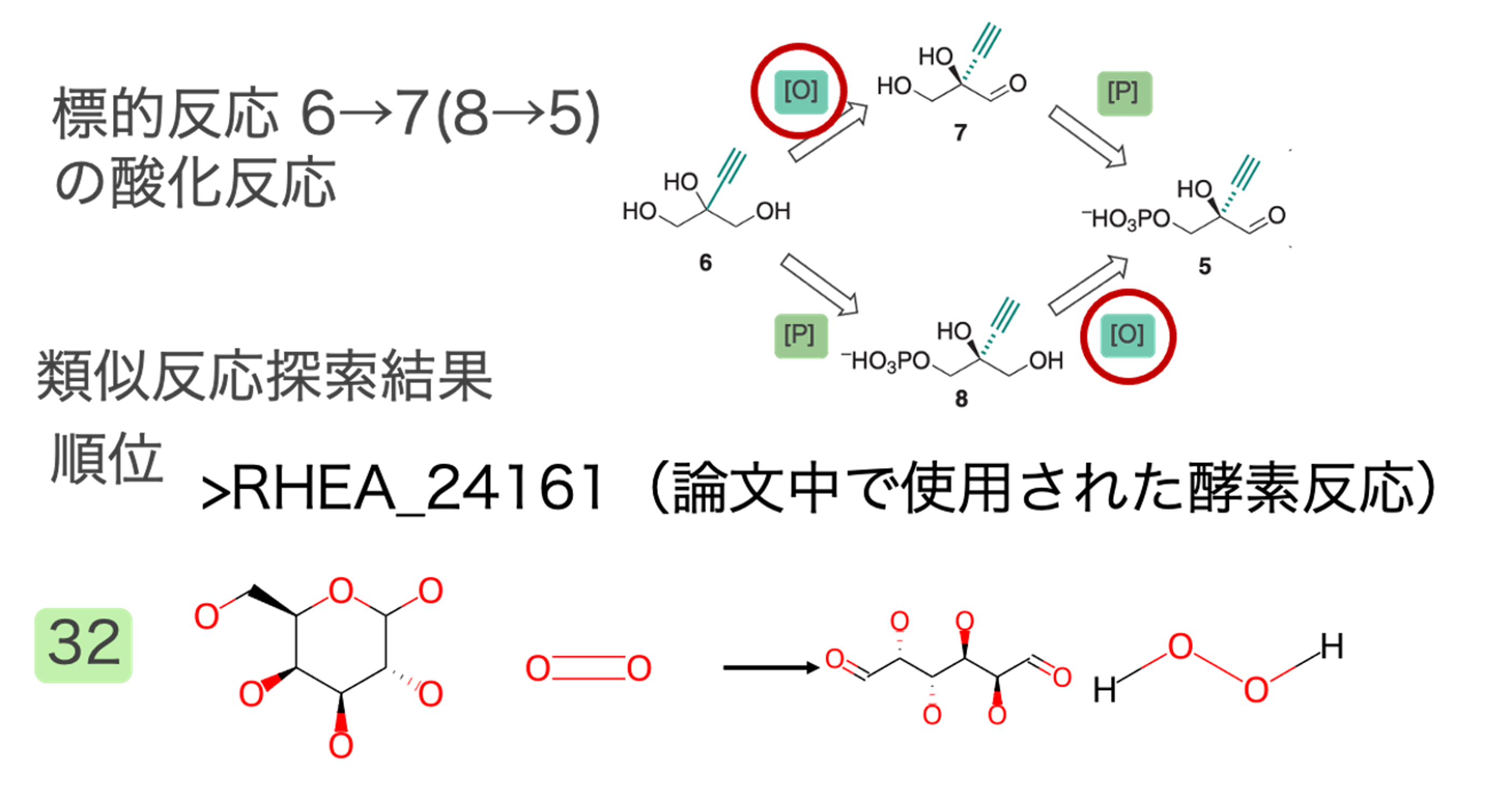
出発物質である6→7 (または8→5)酸化反応の類似反応
水酸基をアルデヒド基に酸化する反応が類似反応として多く抽出されました。標的反応との反応類似度が高い類似反応の一部とその順位を図2に示しました。この反応は既知の代謝反応にはないため複数の類似反応が抽出されました。
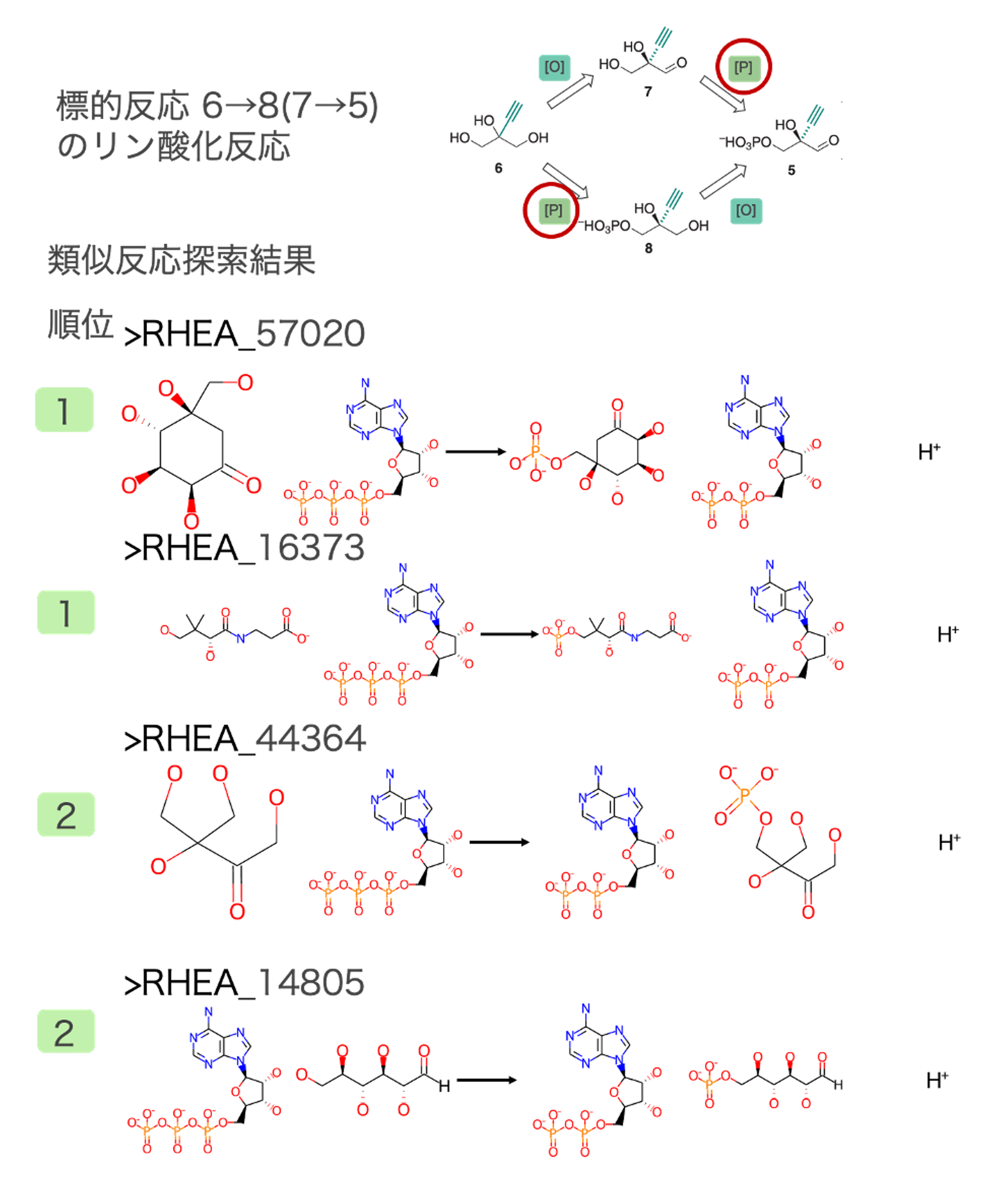
出発物質6→8(または7→5)リン酸化反応の類似反応
水酸基をリン酸化する反応が類似反応として多く抽出されました。標的反応との反応類似度が高い類似反応の一部とその順位を図3に示しました。この反応は上記反応同様、既知の代謝反応にはないため複数候補の類似反応が抽出されました。
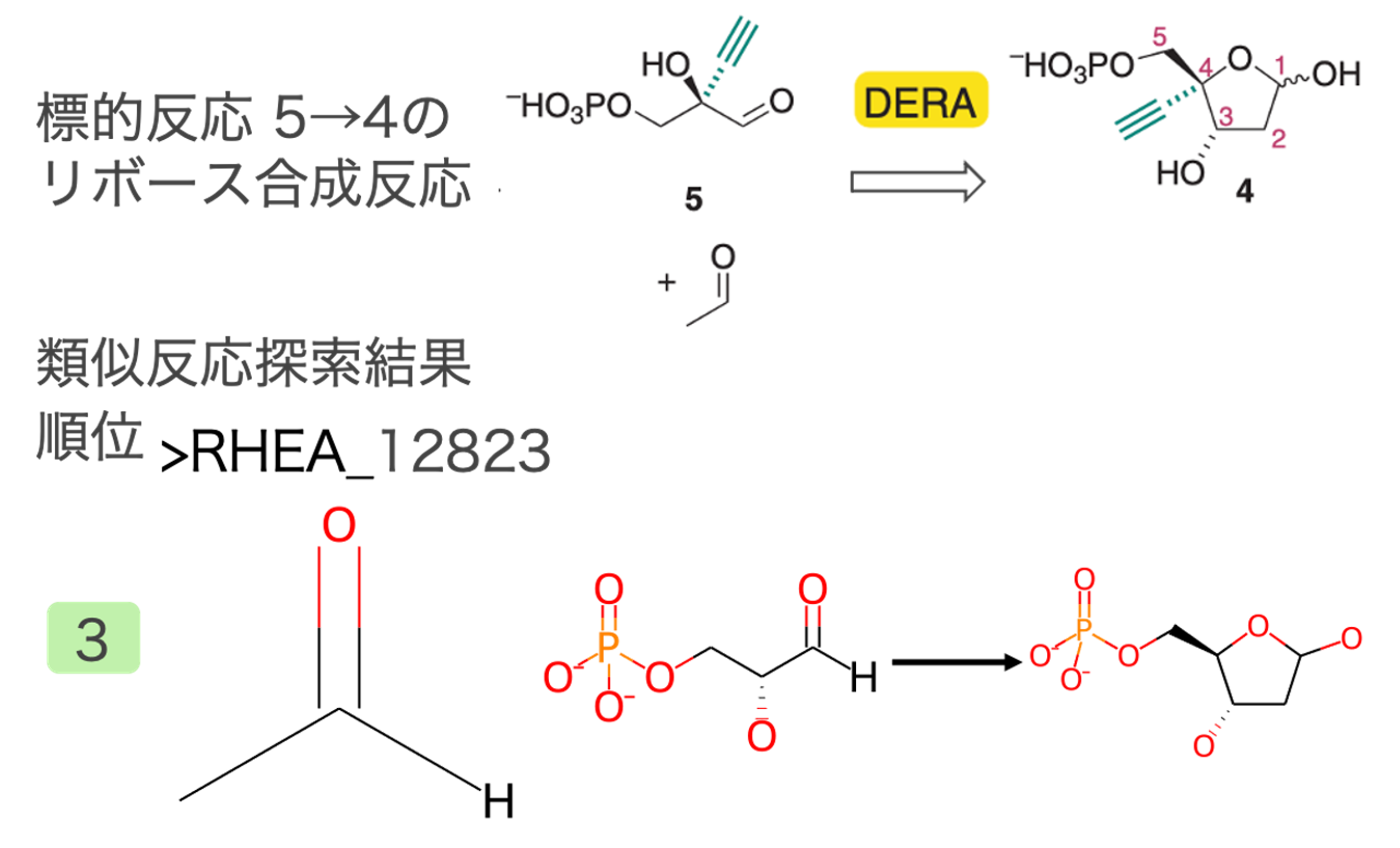
中間体5→4 のリボース合成反応
アセトアルデヒドを添加することで閉環してデオキシリボースとなる反応が抽出されました(図4)。論文中でこの反応は既知の代謝反応を模倣しているため、アルキニル基以外全く同じ反応が類似反応として得られました。
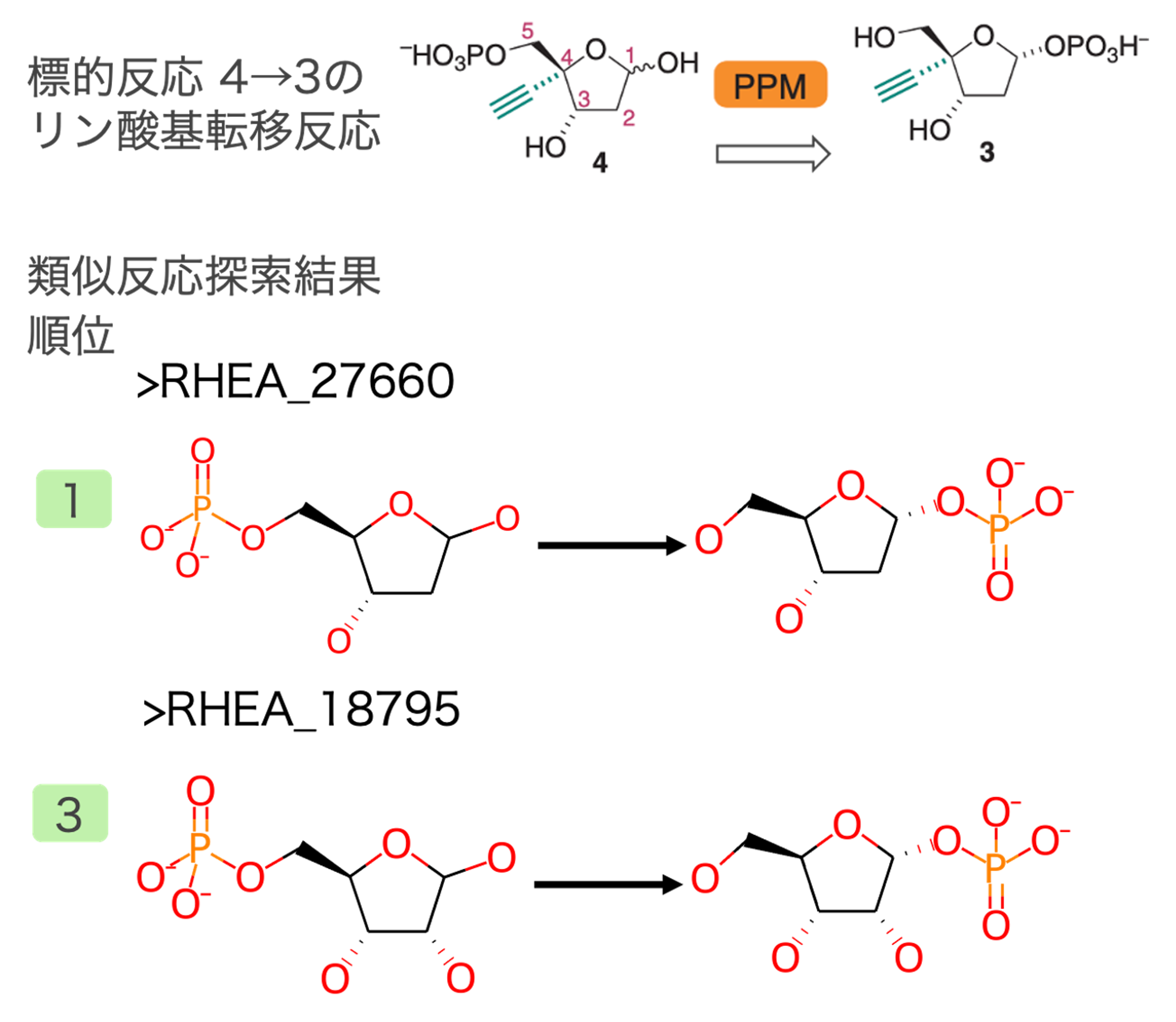
中間体4→3のリン酸基転移反応
リン酸基をヒドロキシアルキル基から水酸基へ転移する反応が抽出されました(図5)。上記リボース合成反応と同様にこの反応も既知の代謝反応を模倣しているため、アルキニル基以外全く同じ反応が類似反応として得られました。
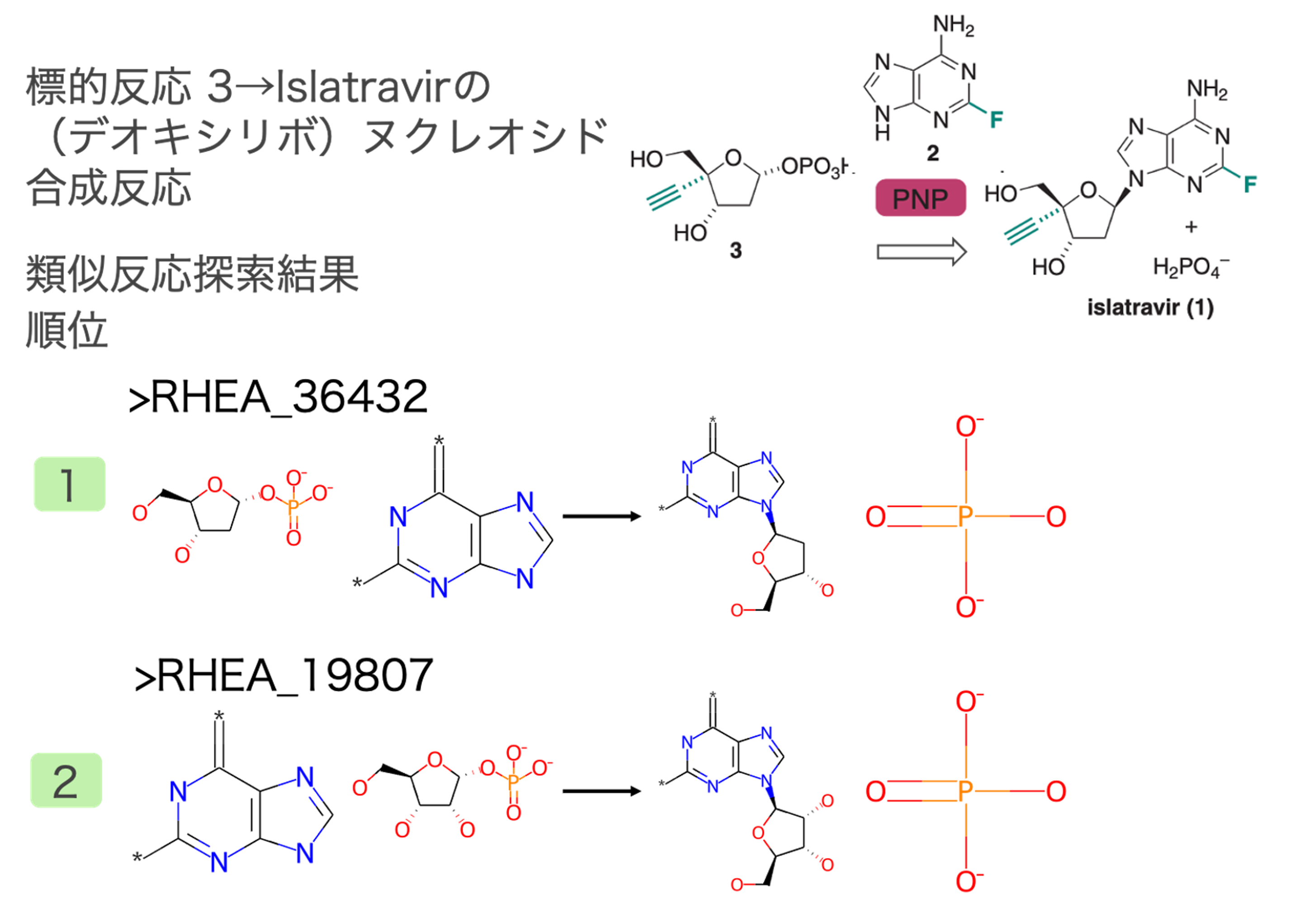
中間体3→Islatravirのヌクレオシド合成反応
プリンをデオキシリボースに付加する反応が抽出されました(図6)。上記リン酸基転移反応と同様にこの反応も既知の代謝反応を模倣しているため、アルキニル基およびフッ素以外全く同じ反応が類似反応として得られました。
2. 類似反応該当酵素探索
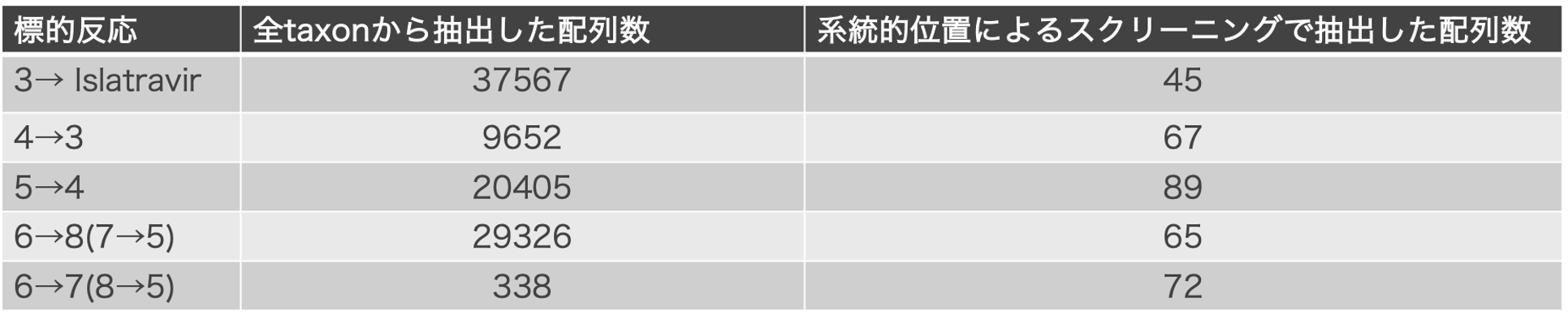
結果1で5反応それぞれの類似反応を抽出しました。この類似反応を担う酵素配列をtaxonごとに抽出しました。絞り込んだ配列の中に論文中で使用された酵素が含まれたかを5反応それぞれで調べました。さらに、5反応それぞれにおいて、全taxon由来の酵素配列から系統的位置を用いたスクリーニングにより配列を絞り込みました。
類似反応のTaxonごとの酵素配列抽出
結果1の類似反応を担う酵素を探索し、Escherichia属、バクテリア、全taxon由来の3段階で抽出しました。抽出した配列数を以下の表1に示しました。今回の論文で使用している酵素と一致するものが含まれていたか調べました。5反応中4反応で、弊社酵素探索技術で抽出した酵素配列に論文中で使用された酵素が含まれていました。
系統的位置によるスクリーニング
全taxonより抽出した上記の類似反応酵素配列から、さらに系統的位置により配列を絞り込みます。全配列をクラスタリング・系統樹を生成、系統的にまとまった配列群から1配列ずつ選定しました。この選定の際、その配列の種間での保存度の高いものを優先して選定します(表2、図7)。

6→7(8→5)の酸化反応についての考察
上記結果にあるように、論文中でこの反応に使用された酵素は今回見つかりませんでした。その要因としては標的反応6→7(8→5)と論文中で使用した酵素反応がそれほど似ていないことにあると考えます(図8)。今回の類似反応探索で見つけた反応も論文中で使用されたO2を利用したOxidoreductaseであり、標的反応を触媒する可能性があると考えます。図9の反応を触媒する酵素として論文中ではUniParc ID: UPI0001E112C2を使用していると推定されます。これはRHEA_24161を触媒することが確認済みの配列のUniRef50のメンバーに含まれています。UPI0001E112C2自体はこの反応を触媒するかcurationされていません。
終わりに
本ブログでは、未知反応を担う酵素の探索を実演しました。材料として論文で触媒する酵素を見つけたIslatravirの新規合成経路を用いました。この経路の各反応を担う酵素を類似反応酵素探索技術を用いて見つけることができるか試しました。5つの未知反応に対して、実際に類似反応をそれぞれ複数抽出しました。この際、任意のtaxonごとに配列を抽出し、それぞれの配列数を示しました。4つの反応では実際に論文で使っていた酵素を含む複数の配列を抽出することができました。そして、系統的位置を加味したスクリーニングで、全taxonから抽出した類似反応酵素を絞り込みました。通常のスクリーニングではさらに、酵素自体の性質(細胞局在など)や3次元構造など他の指標も使って候補配列を絞り込めます。
謝辞
今回の類似反応酵素探索には以下の論文のデータを利用させていただきました。
Huffman et al., (2019) Design of an in vitro biocatalytic cascade for the manufacture of islatravir. Science.
